Hidrogênio
Para acessar o desenho artístico do elemento
hidrogênio,
clique aqui.
Mapa da chave
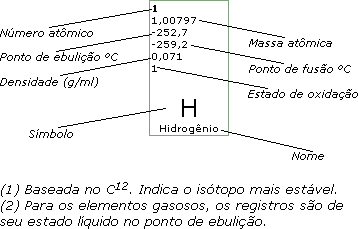
1
1,00797
-252,7
-259,2
0,071
1
H
Hidrogênio |
 |
|
Estrutura do hidrogênio. |
Nas estrelas, o
hidrogênio é convertido em hélio pela fusão nuclear,
processo que proporciona energia das estrelas, entre
elas o Sol. Na Terra, está presente em todas as
substâncias animais e vegetais, na forma de
compostos em que se combina com o carbono e outros
elementos.
O hidrogênio, elemento
do símbolo H, é o mais simples de todos os elementos
químicos, pois é constituído de um próton e um
elétron que gira ao seu redor. Embora na terra ocupe
o nono lugar entre os elementos em termos de
ocorrência, correspondendo a 0,9% da massa do
planeta, é o mais abundante no universo, pois
apresenta cerca de 75% de toda a massa cósmica.
Propriedades
físicas e químicas:
O hidrogênio é uma
substância simples, presente em abundância na
superfície terrestre em combinação com os outros
elementos e, em especial, na água. Em seu estado
molecular, H2, como se encontra na
natureza, constitui-se de dois átomos de hidrogênio,
ligados por covalência, e faz parte das emanações
vulcânicas em proporções reduzidas.
O hidrogênio
molecular, o gás mais leve que se conhece, é
incolor, inodoro, insípido e insolúvel em água. Sua
densidade é 14 vezes menor que a do ar. Ao esfriá-lo
com ar liquefeito e comprimi-lo fortemente, obtêm-se
hidrogênio líquido, que entra em ebulição a -258,8º
C à pressão atmosférica.
Distinguem-se dois
tipos de hidrogênio molecular, em função do sentido
de rotação de seu núcleo ou spin nuclear.
Estas variedades são o para-hidrogênio, menos
energético e com diferentes sentidos de rotação dos
núcleos dos átomos, e o orto-hidrogênio, de maior
energia e com giros análogos. Em temperatura
ambiente, a proporção normal é de três partes do
segundo para uma do primeiro.
O hidrogênio atômico
não se encontra livre na natureza, mas sim combinado
em grande número de compostos. É um elemento de
grande instabilidade e, conseqüentemente, muito
reativo, que tende a ajustar seu estado eletrônico
de diversas formas. Quando perde um elétron,
constitui um cátion H+, que é na
realidade um próton. Em outros casos se produz por
meio do ganho de um elétron para formar o ânion
hídrico H¯, presente apenas em combinações com
metais alcalinos e acalinos-terrosos.
Isótopos do
hidrogênio:
A estrutura atômica do
hidrogênio, a mais simples de todos os elementos
químicos, apresenta um próton, o carga positiva, no
núcleo, e um elétron, ou carga negativa, na camada
externa. Seu peso atômico na escala comparativa
externa. Seu peso atômico na escala comparativa é de
1,00797. A diferença entre esse valor e o observado
para o peso do hidrogênio em seus compostos fez com
que alguns químicos pensassem que não se tratava de
um erro de medida, mas sim do peso combinado de
átomos de hidrogênio de pesos diferentes, ou seja,
de isótopos do hidrogênio. O químico americano Halo
Clauton Urey, prêmio Nobel de química em 1934, e
dois colaboradores detectaram, no resíduo de
destilação do hidrogênio líquido, um hidrogênio mais
pesado. Esse hidrogênio mais pesado, o deutério,
2H ou D, tem um nêutron junto ao próton
do núcleo. Seu número atômico é o mesmo do
hidrogênio normal, mais o peso é 2,0147.
Existe outro tipo de
hidrogênio, o trício, 3H ou T, com dois
números atômicos no núcleo, além do próton, presente
em quantidades mínimas na água natural. O trício é
formado continuamente nas altas camadas da atmosfera
por reações induzidas por raios cósmicos.
Obtenção e
aplicações:
Em pequenas
quantidades, o hidrogênio é normalmente produzido
pela ação do zinco sobre o ácido sulfúrico. Entre
outros processos de produção industrial, cite-se a
ação do vapor ou do oxigênio sobre hidrocarbonetos
como o metano. Em 1783 e a segunda guerra mundial, o
hidrogênio foi usado para encher balões, ainda que,
no caso de dirigíveis para passageiros, o hélio
tenha a vantagem de não ser inflamável. Atualmente
sua principal aplicação é na síntese do amoníaco e
do metanol na difusão do petróleo. Outra aplicação
importante é na hidrogenização de substâncias
orgânicas para produção de solventes, produtos
químicos industriais e alimentos como a margarina e
gordura vegetal. Em outros campos da indústria
química e metalúrgica, emprega-se também o
hidrogênio na fase de redução para metal.
Em outro contexto, a
explosão de uma bomba de hidrogênio, também chamada
termonuclear, é causada pela colisão e fusão de
núcleos leves de hidrogênio, deutério e trício. A
obtenção de um meio de controlar a reação de fusão
pode levar a uma fonte de energia praticamente
inesgotável, já que tem como combustível a água do
mar, de altíssimo rendimento e grande pureza, por
não gerar subprodutos.

